

























前天下午(4月27日),博济医药首档线上直播系列课程“博济研语”正式开播,第一期课程题目为《如何召开有效的Pre-IND meetings》,由博济医药医学总监朱飞兵担纲主讲人。
“Pre-IND meetings起源于美国,在1992年被FDA正式确认为加快药品研发和审评审批的流程之一。经过近年来不断的发展与演变,如今像Pre-IND meetings一样的沟通交流制度在美不止应用于首次临床试验前,在临床I期、II期、III期前以及Pre-NAD/BLA期间均有广泛应用。”
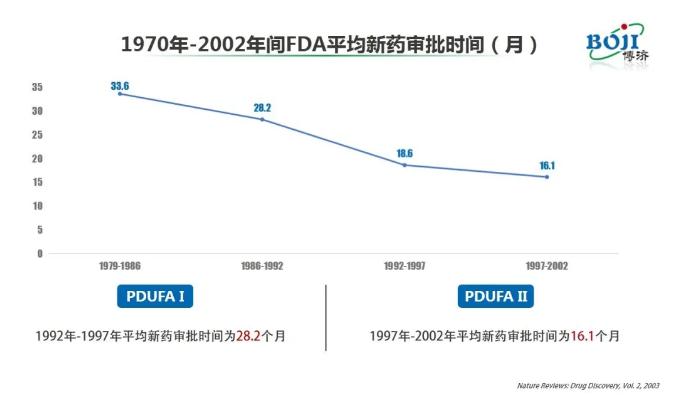
演讲伊始,朱飞兵就向广大网友介绍了Pre-IND meetings的历史沿袭。在他看来,自形成Pre-IND meetings制度以后,FDA新药审评速度明显加快。数据显示,在1997年-2002年间美国平均新药审批时间为16.1个月,较此前的1979年-1986年间缩短了50%以上。



是免费的,是CDE给我们的福利。但是Pre-IND meetings沟通交流会的开展是有前提的,当线上或非当面的沟通无法解决疑问或问题的时候才有必要或可以申请交流会,建议会上尽可能讨论未解决的问题,以提高会议效率。
通常从递交Pre-IND meetings申请到CDE反馈是15个工作日(适应症团队讨论10日+项目管理人通知5日),告知申请人会议类型、日期、地点、会议内容,以及药审中心拟参会人员等信息。正式会议从提出日算起,Ⅰ类会议一般不会超过30个工作日,Ⅱ类会议一般不会超过60个工作日,Ⅲ类会议一般不会超过75个工作日。
通过申请人之窗,与CDE的项目管理人联系。
一般情况下先确定我们希望召开的会议类型,特别是Ⅰ类会议的《沟通交流会议资料》应与《沟通交流会议申请表》同时提交,也就是说我们只有拿到数据后才能提交申请。Ⅱ类和Ⅲ类会议的《沟通交流会议资料》应在会议召开30日前提交,有个技巧:可以在试验快结束前就试验中发现的问题,先准备明确的问题,并就这些问题提出Pre-IND meetings的申请,但应计算好时间。我们只有拿到数据后,并对这些数据进行整理后才能去提交《沟通交流会议资料》,需预留出30个工作日,以利于CDE审评。另外,我们不要提出开放性的问题,比如,问CDE:“这个药我应该怎么做毒理、药理试验?”如果这样,CDE会回复按照法规做就可以了。
如果申请II类会议,CDE召开会议的时限是60个工作日,不是60天。只要按工作日计算,这个策略是可以的。前提是拿到数据后,快速准备好你的支持数据,能够及时提交,给CDE去做选择题,明确相关问题是否能一同在会议中讨论。但需要注意,采用这个策略可能会出现因为会议管理要求无法补充提问,或因为没有与问题相对应的参会专家而无法在会中解决新增问题这样的情况。
我们提供给CDE的应该是尽量完整的临床前动物实验数据,但并不需要就每个试验环节都提出问题。问题应该集中,并只提出我们拿不准的问题,当然,CDE的适应症团队会审评我们的资料,如果没有搞清楚产品的CMC、药理、药效信息等,他们也会在初步会前反馈中提出,我们再积极回应这些问题,将它们拿到正式会议上讨论即可。
这当然有。更多内容可关注博济子公司:美国汉佛莱医药顾问有限公司,目前是国内最大的FDA注册团队,也是国内首家拥有FDA“电子申报“能力的公司,公司主要提供:药品注册申报、临床前顾问、申报成功的药物涉及多种领域,主要包括小分子化药,双抗靶点药物,CAR-T细胞,植物药等。目前已有100多项成功案例。

